Capitulo 4- Modelo de Bohr
Tratamento Clássico do Átomo de Hidrogênio
A fig. 4.1 apresenta uma ilustração muito simplificada do modelo de Bohr para o átomo de hidrogênio.
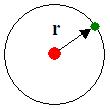
Tem-se um elétron (carga -e) numa órbita com raio r em torno de um núcleo com carga +e. A força centrípeta sobre o elétron é dada por
Esta força vem da interação coulombiana entre o núcleo e o elétron, isto é,
Assim, a velocidade do elétron é uma função do raio, dada por
A energia total do elétron (E) é dada pela soma da energia cinética (mv2/2) e da energia potencial eletrostática (-e2/4pe0r)
É fácil mostrar que
Considerando que são necessários 13.6 eV para separar o elétron do próton no átomo de hidrogênio, tem-se que -13.6 eV é a energia de ligação do elétron neste átomo. Mostre que o raio da órbita do elétron, no átomo de hidrogênio, é aproximadamente 5.3 x 10-11 m.
| |
|
|