Capitulo 4 - Modelo de Bohr
Os Postulados de Bohr
Para evitar a contradição do modelo atômico com a teoria clássica do eletromagnetismo, Bohr elaborou os seguintes postulados:
Usando-se as eqs. (4.9)-(4.11), é fácil mostrar que a energia em cada estado estacionário, ou nível n, é dada por
onde E é dada em eletronvolt, eV. O raio da órbita é dado por
onde rB é o raio de Bohr, cujo valor é dado pela eq. (4.9). Ele corresponde à órbita com n=1. Esse nível é conhecido como estado fundamental do átomo de hidrogênio. É o estado que corresponde à menor energia, isto é, -13,6 eV. Para qualquer átomo, o estado correspondente à menor energia é o estado fundamental. Vamos discutir um pouco mais essa questão, para o caso específico do átomo de hidrogênio. Para átomos com mais de um elétron a discusão é bem mais complicada, e está fora do escopo do presente material.
A figura 4.2 ilustra o modelo.
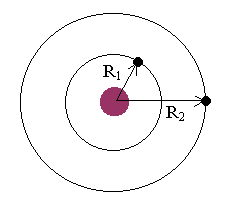
As órbitas com raios R1 e R2 representam dois estados estacionários. O elétron pode permanecer em cada um deles sem irradiar. No entanto, ele só permanece em raios superiores ao raio de Bohr, por um curto intervalo de tempo, da ordem 10-8 segundos. Depois desse tempo de permanência, ele retorna sucessivamente para órbitas mais internas, até parar no estado fundamental. Neste retorno o átomo emite fótons, cujas freqüências podem ser calculadas a partir da relação E=hf. Isto é,
Se não houver uma ação externa, como um fóton, ou outra partícula incidente, o elétron permanecerá indefinidamente no estado fundamental. Agora, se um fóton com energia E2-E1 interagir com um átomo de hidrogênio no estado fundamental, o elétron saltará para o estado com n=2. É assim que tem início o processo que dá origem às séries espectroscópicas.
A partir da eq. (4.14), e tendo em conta que l = c/f, obtém-se
A eq. (4.15) tem a mesma forma das eqs. (4.1)-(4.5). Isto é, as séries espectrais são exatamente transições entre níveis estacionários do átomo de hidrogênio. As linhas da série de Lyman são transições dos níveis com n maior ou igual a 2 para o nível 1. Transições dos níveis com n maior ou igual a 3 para o nível 2 fornecem a série de Balmer. A série de Paschen resulta de transições para o nível 3, a de Brackett para o nível 4, e a de Pfund para o nível 5.
Com a simulação abaixo podemos reproduzir essas séries espectroscópicas. Temos inicialmente um átomo de hidrogênio com oito níveis estacionários, cada um representado pela órbita correspondente. O ponto verde representa o núcleo (próton), e o vermelho representa o elétron. A série é definida pelo nível final da transição. Os botões à direita permitem esta definição. Por exemplo, se quisermos observar a série de Lyman, deveremos clicar no botão 1. Para produzir a primeira linha desta série, deveremos clicar na segunda órbita.
Observe que aparece uma seta amarela conectando a segunda e a primeira órbita. Na escala horizontal aparece uma linha branca, indicando o comprimento de onda da radiação emitida, igual a 121,5 nm. Na escala vertical, representando os níveis de energia, aparece uma seta branca, indicando uma transição associada a um fóton de 10,2 eV.
Os traços brancos na escala horizontal representam as linhas espectrais do hidrogênio, na faixa entre 0 e 2000 nm. Lembre-se que a faixa visível fica entre 400 e 650 nm. Escolha uma transição qualquer. Por exemplo, do nível 4 para o 2. Observe que uma linha verde aparece na escala horizontal, e que uma seta verde aparece na escala vertical. Mostre que a radiação emitida cai na faixa da luz verde.
Reproduza algumas linhas espectrais e compare os valores exibidos pelo programa com aqueles calculados através das eqs. 4.12 e 4.15.
| |
|
|