|
Divulgação Científica |
|
Voltar à edição corrente / Mapa do spin
|
Superaquecimento no forno de microondasFernando Lang da SilveiraInstituto de Física - UFRGSLíquido aquecido no forno de microondas pode se apresentar em estado de superaquecimento, isto é, atingir temperaturas superiores à temperatura de ebulição sem que ocorra a ebulição. Quando o aquecimento é realizado sobre uma chama, as correntes de convecção perturbam suficientemente o sistema para que ferva assim que é atingida a temperatura de ebulição.
Figura 2 – Explosões da água superaquecida. A ocorrência de explosões em líquidos superaquecidos pode provocar queimaduras em incautos usuários do forno de microondas. O leitor interessado em mais detalhes sobre os estados metaestáveis de superaquecimento no forno de microondas, inclusive com água destilada e com leite, poderá encontrá-los no texto de minha autoria, disponibilizado no seguinte endereço: http://www.if.ufrgs.br/fis183/applets.html. Naquele texto também abordo a superfusão, isto é, a ocorrência do estado líquido em temperaturas inferiores à temperatura de fusão.
|
||||
|
Roentgênio, o elemento químico com Z=111C.A. dos SantosInstituto de Física – UFRGSIntrodução
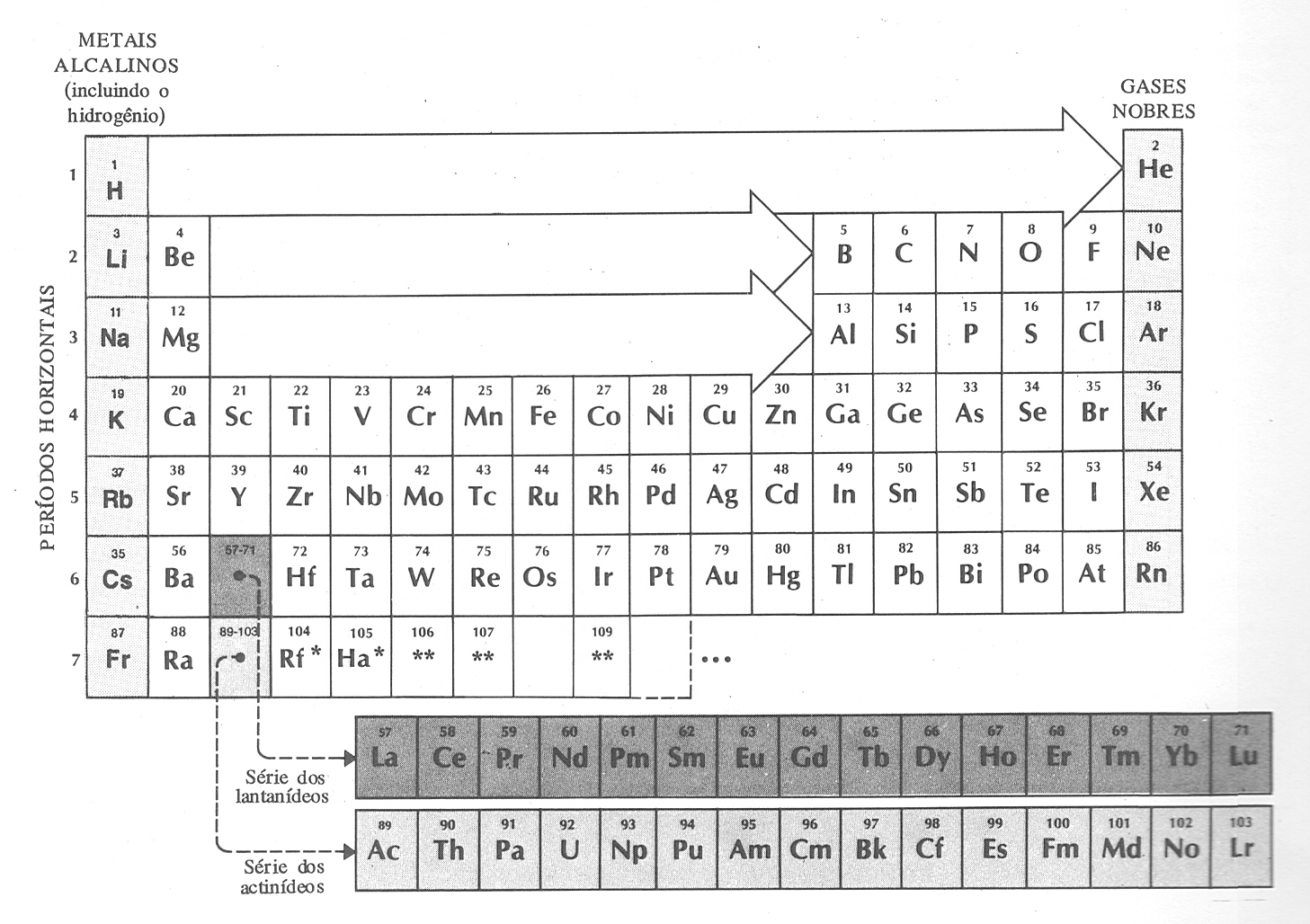
A tabela periódica de Mendeleiev
Na seqüência ele distribuiu os elementos no formato semelhante ao que hoje conhecemos, conforme figura abaixo.
A tabela periódica moderna
Os elementos assinalados com um asterisco (Rf e Ha) ainda não tinham os nomes aprovados na época da publicação desta tabela. Os elementos com Z=106, 107 e 109 já haviam sido descobertos, mas ainda não havia propostas de nomes. Em 2001 esta tabela já estava diferente3..
O elemento químico com Z=1115 Como é da tradição, o nome do elemento, Roentgênio, símbolo Rg, foi proposto pelos seus descobridores. A denominação internacional é Roentgenium, e foi dada em homenagem ao descobridor dos raios X, o físico alemão Wilheim Conrad Roentgen. O peso atômico do Rg é 272, de modo que seu núcleo contém 161 nêutrons. O elemento é obtido através do bombardeio de bismuto com um feixe de íons de níquel a uma energia da ordem de 316 MeV. Referências1. TRIFONOV, D.N., TRIFONOV, V.D. Como fueron descubiertos los elementos quimicos. Moscou: Editorial Mir, 1984; RADVANYI, P., BORDRY, M. Histoires d'atomes. Paris: Éditions Belin, 1988; STRATHERN, P. O sonho de Mendeleiev. Rio de Janeiro: Jorge Zahar Editor, 2002; HORVITZ, L.A. Eureca!: descobertas científicas que revolucionaram o mundo. Rio de Janeiro: Bertrand Brasil, 2003.Voltar ao texto 2. HALLIDAY, D., RESNICK, R. Fundamentos de Física, v.4. Ótica e Física Moderna. Rio de Janeiro: Livros Técnicos e Científicos, 1991. Voltar ao texto 3. Página do Los Alamos National Laboratory's Chemistry Division. Acessada em 14/11/2004. Voltar ao texto 4. CORISH, J., ROSENBLATT, G.M. Name and symbol of the element with atomic number 111. IUPAC Provisional Recommendation. Draft 17 May 2004. Voltar ao texto 5. HOFMANN, S. et alli. New results on elements 111 and 112. The European Physical Journal A, 14 (2002)147-157. Voltar ao texto O autor agradece a José Tullio Moro por lhe chamar a atenção para a decisão da IUPAC. |