O homem utiliza vários recursos para facilitar suas tarefas diárias,
como locomoção e construção e ao longo de sua história já utilizou a própria força, a força de animais, ferramentas e máquinas
simples até que passou a utilizar o calor em um processo de transformação da energia térmica em trabalho.
Com a invenção das máquinas térmicas, no século XVIII, o homem deixou de depender de seu esforço e resistência, mas se tornou dependente do combustível que fornece a fonte de calor, como o carvão.
As máquinas térmicas, por serem mais eficientes e possibilitarem maior produtividade, geraram fábricas e indústrias e com elas tecnologia, surgindo uma nova era de desenvolvimento chamada "revolução industrial".
E até hoje o homem procura aperfeiçoar e criar novos tipos de motores para movimentarem essas máquinas e também busca novas e econômicas fontes de energia.
A TERMODINÂMICA surgiu da necessidade de compreensão do funcionamento das
máquinas térmicas visando otimizar o seu uso. Assim, a termodinâmica estuda as relações existentes entre o calor e o
trabalho mecânico, tendo como princípios a conservação de energia e a transferência espontânea do calor, do sistema
mais quente para o mais frio e não no sentido inverso.

No estudo da termodinâmica, é comum o uso dos termos sistema e meio ou vizinhança, onde sistema é a parte que
nos interessa, é uma parte fechada e bem definida e meio é tudo o que está
fora do sistema, na sua vizinhança.
Por exemplo, estamos estudando o comportamento de um gás quando sofre aumento de temperatura. O sistema é o gás e o meio é a fonte
de calor que provoca o aumento de temperatura. Ou ainda, no estudo do nosso planeta, a Terra é o sistema, enquanto que o resto do Universo é o meio.
A termodinâmica é compreendida por duas leis que regem os fenômenos que envolvem transferências ou transformações de energia.
A Primeira Lei da Termodinâmica é fundamentada no Princípio da Conservação de Energia que diz:
"A energia não pode ser criada nem destruída apenas transformada de uma forma em outra, ou seja, a quantidade
de energia total permanece constante".

Ocorrem na natureza, várias transformações ou conversões de uma forma de energia em outra. Por exemplo, a energia luminosa do Sol é devida à transformação da energia nuclear em energia radiante; a energia eólica (dos ventos) é convertida em energia elétrica, assim como a energia solar.
Ou ainda, a água dos oceanos e lagos evapora-se na atmosfera devido ao aquecimento produzido pela energia radiante do Sol. O vapor se condensa (nuvens) e forma-se a chuva que cai e move geradores de usinas elétricas e a corrente elétrica adquirida pode iluminar casas ou carregar baterias químicas como a de um automóvel que se transforma em energia mecânica possibilitando o movimento do veículo.
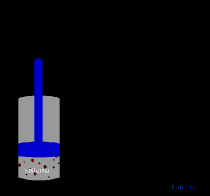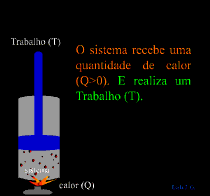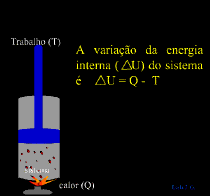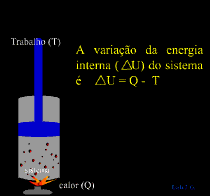
A Primeira Lei da Termodinâmica estabelece que a energia total do sistema é constante, portanto, se durante a conversão de energia, alguma quantidade não for encontrada é porque foi transformada em outro tipo de energia e deverá aparecer em algum lugar.
Quando flui calor para um sistema ou de um sistema, esse sistema está ganhando ou cedendo uma quantidade de energia igual a quantidade de calor transferido.
A Primeira Lei também determina que se, um sistema receber energia na forma de calor (Q), pode utilizar essa energia para
aumentar sua energia interna ( U) e/ou para
realizar trabalho (T) sobre o meio externo.
U) e/ou para
realizar trabalho (T) sobre o meio externo.

Precisamos verificar o que está ocorrendo com o sistema. Vamos supor que
os sistema seja um gás ideal contido em um cilindro com êmbolo móvel. Nas figuras temos dois casos.
Estudos de experimentos como o de Joule, por exemplo, que provou que o calor podia ser transformado em trabalho mecânico
e vice-versa, mostraram que cada vez que ocorre a conversão, parte dessa energia se perde como calor inútil - para esse sistema - que se difunde no universo (podendo ser reaproveitada por outro sistema), isto é, enquanto a energia é transformada, é possível realizar um trabalho, mas uma parte dessa energia não é aproveitada, ocorrendo o que se chama de
degradação de energia.
Por exemplo, para colocarmos um automóvel em funcionamento, é preciso que haja combustível. Ao acionarmos a chave provocamos uma faísca que faz com que queime a gasolina e uma parte da energia química armazenada na gasolina é transformada em trabalho quando os gases provindos da queima empurram o pistão do motor, e uma parte da energia surge como energia radiante ou energia térmica que não é aproveitada.
É sobre esta degradação de energia que trata a Segunda Lei da Termodinâmica que pode ser enunciada da seguinte forma:
"É impossível transformar todo calor em trabalho".
O que está relacionado com o fato de que o calor não flui espontaneamente de um corpo frio para um corpo quente.
É comum no inverno, ouvirmos, quando em uma sala fechada e alguém abre a porta, outra pessoa dizer: "fecha a porta para o frio não entrar!". Realmente, no inverno o interior dos ambientes é mais aquecido que o exterior, porém ao abrir-se uma porta é o calor que flui do interior para o exterior e não o contrário, o que violaria a Segunda Lei da termodinâmica.
Um outro exemplo: uma pedra de gelo colocada em um copo com água a temperatura ambiente recebe calor da água e derrete, mas jamais cederá calor para a água, pois, o gelo não ficará mais frio e nem a água mais quente, o que violaria a Segunda Lei da termodinâmica. Contudo, não viola a Primeira Lei, pois a conservação de energia seria mantida de qualquer modo.
Assim podemos dizer que a conservação de energia ocorre em toda transformação, porém essas transformações ocorrem espontaneamente em um só sentido por isso os processos termodinâmicos são ditos irreversíveis.
Nos processos reversíveis o sistema pode retornar a situação inicial como, por exemplo, um pêndulo ou um sistema massa-mola ideal.
Nos
processos irreversíveis, o sistema não pode espontaneamente retornar a situação inicial, e é isso o que ocorre com todos os processos reais como, por exemplo,
a pedra de gelo que recebe calor da água líquida na temperatura ambiente, mas não cede calor para a água.
Nas tranformações de calor em trabalho, uma parte se perde como calor inútil, ou seja, ocorre a degradação da energia, e a medida gradual da degradação de energia até a condição de inútil (para o sistema em análise) é denominada entropia, palavra inventada pelo físico alemão Rudolf Julius Emmanuel Clausius, em 1865.
Se colocamos uma chaleira com água no fogo, conforme a temperatura for aumentando, sai vapor pelo bico da chaleira. As moléculas do vapor tem uma direção preferencial e poderiam empurrar um pistão de uma pequena máquina a vapor, realizando trabalho, mas depois que o vapor sai do bico se dissipa no ar, e as moléculas se movimentam em todas as direções de modo desordenado aquecendo o ar mais frio e, gradualmente, perdem sua energia útil.
Desta forma o vapor e o ar tendem a atingir o equilíbrio térmico, isto porque há uma tendência da natureza de igualar temperaturas à medida que a ordem passa para a
desordem, ou seja, quando a desordem molecular aumenta. Assim, a entropia pode ser definida como uma medida do grau de desordem do sistema, enunciado elaborado pelo físico Ludwig
Boltzmann (o mesmo da radiação de corpo negro).
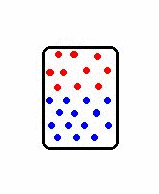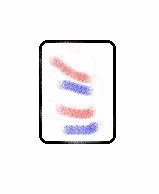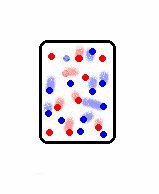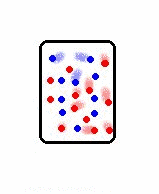
Os sistemas ordenados possuem baixa entropia, enquanto os sistemas desordenados possuem alta entropia. Por exemplo, os sistemas no estado sólido possuem maior ordenamento molecular do que os sistemas nos estados líquido e gasoso, e nestes, os átomos e moléculas estão em constante agitação. Logo os gases possuem maior entropia do que os líquidos e estes maior entropia do que os sólidos.
A entropia é tão importante quanto a energia e influencia nossa vida de modo semelhante, porém, ao contrário da energia que conserva sua quantidade total,
a entropia não se conserva e, em um processo natural, a entropia do universo sempre aumenta e é dessa forma que sabemos se o processo é espontâneo.

Se o nosso Universo é o sistema e há uma tendência de uniformidade da temperatura e, portanto, uma situação de desordem, ou seja, um estado de máxima entropia, o Universo não se autodestruirá?

Chegará o tempo em que a temperatura do Universo será rigorosamente constante e não ocorrerá nenhum trabalho e toda ação cessará e, portanto, o tempo cessará?
O nosso Universo, em virtude dos processos naturais, tende para um estado de desordem maior e uniformidade geral, assim, a energia disponível para realizar trabalho útil irá diminuir e todos os processos físicos, químicos, etc... cessarão, atingindo uma situação limite denominada de Morte Térmica.
Mas cuidado! A energia total do universo é constante e o que está diminuindo é a quantidade de energia disponível para a realização de trabalho, enquanto a entropia do Universo está aumentando.
Para que a morte do Universo fosse verídica para a termodinâmica, seria necessário que o Universo fosse um sistema isolado, isto é, fechado, sem influências externas, mas não sabemos se não há nada além do Universo, isto é, se ele é isolado, é isolado do quê? A termodinâmica é aplicada a pequenos sistemas, então, será que pode ser aplicada a sistemas tão grandes quanto o Universo?
Cientistas descobriram que a energia solar provém da fusão nuclear no interior do Sol, onde há conversão da matéria em energia e que isto ocorrerá por mais ou menos 30 bilhões de anos, o que
seria o nosso fim. Porém, alguns
astronômos acreditam que há formação de matéria com energia útil sendo constantemente criada no espaço e ,se isso for verdade, talvez não ocorra a morte do Universo.
Façamos alguns exercícios!
Para entendermos melhor a termodinâmica vejamos a aplicação de suas Leis às máquinas térmicas.

