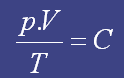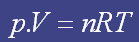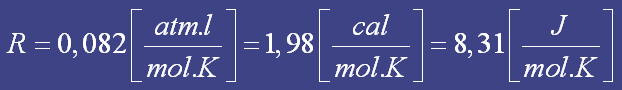Podemos perceber que a equação não faz nenhuma referência ao tipo de molécula de gás. A conseqüência desse fato é a que a equação é incapaz de prever os efeitos das interações intermoleculares. Porque se duas moléculas com grande interação intermolecular se cruzam próximas uma da outra existe uma força de atração, diminuindo a energia cinética, o que diminuiria a pressão total do sistema em relação ao esperado no caso de não haver tal interação. Por isso é preciso que o sistema esteja em alta temperatura e baixa pressão.
No primeiro caso, com a temperatura alta, a alta energia cinética faz com que os choques entre as moléculas sejam quase elásticos, e quando elas se aproximam a interação seja por um momento curto e a interação acaba não sendo o suficiente para mudar a trajetória das partículas no gás.
No segundo caso, com a baixa pressão, as moléculas estão muito afastadas. E como a interação depende fortemente da distância das partículas, grandes distâncias fazem com que o efeito de interação seja praticamente desprezível.