Lista de Exercícios - Física Quântica - UNIDADE 2
Problemas e
questões baseados no D. Halliday, R. Resnick e J. Walker, Fundamentos
de Física, 4ª ed. - caps. 43, 44 e 45, e 6ª ed. - cap. 39, 40 e 41.
Questões:
1. Como pode a energia de um fóton ser dada por E = hf, quando a simples presença da freqüência f indica que a luz é uma onda?
2. Uma placa de metal isolada emite fotoelétrons ao ser iluminada por luz ultravioleta, mas, depois de certo tempo, deixa de emiti-los. Explique o porquê.
3. No efeito fotoelétrico, por que a existência de uma freqüência de corte conta a favor da teoria dos fótons e contra a teoria ondulatória?
4. Por que as medições fotoelétricas são muito sensíveis à natureza da superfície fotoelétrica?
5. A teoria de Einstein, dos fótons, que admite ser a luz uma corrente de fótons, invalida a experiência da interferência numa fenda dupla, de Young, em que a luz se comporta como uma onda?
6. Por que não se observa o efeito Compton com a luz visível?
7. Os radioastrônomos observam raias do espectro de hidrogênio que provêm de átomos de hidrogênio que estão em estados com n = 350 ou mais. Por que não é possível obter e estudar átomos de hidrogênio, em estados com números quânticos tão elevados, nos laboratórios?
8. Um átomo de hidrogênio pode absorver um fóton cuja energia seja maior que a sua energia de ligação (13,6 eV)?
9. Discuta a analogia entre (a) ótica ondulatória e ótica geométrica, e (b) mecânica ondulatória e mecânica clássica.
10. Enuncie e discuta (a) o princípio da correspondência, (b) princípio da incerteza e (c) o princípio da complementaridade.
11. Por que o conceito das órbitas de Bohr viola o princípio da incerteza?
12. Compare a teoria de Bohr e a mecânica ondulatória. Em que aspectos elas concordam? Em que aspectos diferem?
13. Porque não se observa a quantização espacial para um pião girando?
14. Quais são as dimensões e quais as unidades SI de uma função de onda do átomo de hidrogênio?
15. Por que os elementos lantanídeos (veja o Apêndice E) têm propriedades químicas tão semelhantes? Por que seria justificável colocá-los todos num único quadrado da tabela periódica? Por que, apesar da semelhança das propriedades químicas, eles podem ser tão facilmente distinguidos pelos espectros de raios X característicos?
16. Porque os comprimentos de onda das radiações geradas por transições nas camadas mais internas dos átomos são menores que os comprimentos de onda das radiações geradas por transições nas camadas periféricas dos átomos?
17. O átomo de hidrogênio pode emitir raios X? Em caso positivo, descreva como. Em caso negativo, explique as razões.
18. Porque a teoria de Bohr, que não funciona muito bem para o átomo de hélio (Z = 2), dá resultados tão bons para os espectros de raios X característicos dos elementos?
19. Temos emissão espontânea e emissão estimulada. Por simetria, por que não temos também absorção espontânea e absorção estimulada?
Problemas: (marcados com J são fortemente sugeridos)
CAPÍTULOS
43 - 4a ed. e 39 - 6a ed.
1. Mostrar que a energia E de um fóton (em eV) está
relacionada com o comprimento de onda (em nm) por![]() .
Esse resultado tem utilidade na resolução de muitos problemas. (43 - 1, 39 - 3)
.
Esse resultado tem utilidade na resolução de muitos problemas. (43 - 1, 39 - 3)
J
Resposta: 2,11 eV.
J 3. Certo fóton de raios-X tem o comprimento de onda de 35,0 pm. Calcular: (a) energia do fóton; (b) a sua freqüência; (c) o seu momento linear. (43 - 5)
Resposta: .(a) 35,4 keV; (b) 8,6 x 1018 Hz; (c) 35,4 keV/c.
4. Em condições ideais, o olho humano normal registra uma sensação visual a 550 nm, quando os fótons incidentes são absorvidos numa taxa tão baixa quanto 100 fótons por segundo. A que potência corresponde essa taxa? (43 - 6, 39 - 10)
Resposta: 3,6´ 10- 17 W.
J 5. Quais são: (a) a freqüência; (b) o comprimento de onda e (c) o momento de um fóton, cuja energia é igual à energia de repouso do elétron? (43 - 7)
Resposta: (a) 1,24 x 1020 Hz; (b) 2,43 pm; (c) 0,511 MeV/c.
J 6. Você deseja escolher uma substância para uma fotocélula, que irá operar, pelo efeito fotoelétrico, com luz visível. Quais, dentre as seguintes: tântalo (4,2 eV), tungstênio (4,5 eV), alumínio (4,08 eV), bário (2,5 eV) e lítio (2,3 eV), seriam escolhidas? A função trabalho de cada uma está entre parênteses. (43 - 14, 39 - 17)
Resposta: Bário e Lítio.
J 7. Um satélite artificial, ou uma astronave, em órbita terrestre, pode ficar eletricamente carregado, em virtude da perda de elétrons por efeito fotoelétrico, provocado pelos raios solares na sua superfície externa. Suponha que um satélite esteja revestido por platina, metal que tem uma das maiores funções trabalho: f = 5,32 eV. Determine o maior comprimento de onda do fóton capaz de ejetar elétrons da platina. (Os satélites têm que ser projetados de modo a minimizar este efeito.) (43 - 15)
Resposta: 233,1 nm.
8. (a) A energia necessária para remover um elétron do sódio metálico é 2,28 eV. Uma luz vermelha, com l = 680 nm, provocará efeito fotoelétrico no sódio? (b) Qual o comprimento de onda do limiar fotoelétrico do sódio e a que cor corresponde esse limiar? (43 - 16, 39 - 16)
Resposta: (a) Não; (b) 543,86 nm - verde.
J 9. (a) Se a função trabalho de um metal for 1,8 eV, qual o potencial de corte para a luz de comprimento de onda 400 nm? (b) Qual a velocidade máxima dos fotoelétrons emitidos da superfície do metal? (43 - 21, 39 - 22)
Resposta: (a) 1,3 V; (b) 676,7 km/s.
J 10. O potencial de corte dos fotoelétrons emitidos por uma superfície iluminada por luz com o comprimento de onda de 491 nm é 0,710 V. Quando o comprimento de onda da radiação incidente assume um outro valor, o potencial de corte passa a ser 1,43 V. (a) Qual esse novo comprimento de onda? (b) Qual a função trabalho da superfície? (43 - 23, 39 - 27)
Resposta: (a) 382 nm; (b) 1,82 eV.
J 11. Em 1916, R.A. Millikan encontrou os seguintes valores do potencial de corte em experiências feitas com o lítio:
|
Comprimento de onda em (nm) |
433,9 |
404,7 |
365,0 |
312,5 |
253,5 |
|
Potencial de corte (V) |
0,55 |
0,73 |
1,09 |
1,67 |
2,57 |
Com esses dados, faça um gráfico do potencial de corte versus a freqüência e obtenha: (a) a constante de Planck; (b) a função trabalho do lítio. (43 - 25, 39 - 28)
J 12. Fótons com o comprimento de onda de 2,4 pm incidem sobre um alvo que contém elétrons livres. (a) Determine o comprimento de onda para um fóton que é espalhado num ângulo de 30° em relação à direção de incidência. (b) Faça o mesmo cálculo quando o ângulo de espalhamento for 120°. (43 - 29, 39 - 31)
Resposta: (a) 2,73 pm; (b) 6,04 pm.
J 13. Um fóton de raios-X, com 0,01 nm, faz uma colisão frontal com um elétron (f = 180° ). Determine: (a) a variação do comprimento de onda do fóton; (b) a variação da energia do fóton; (c) a energia cinética adquirida pelo elétron; (d) a velocidade do elétron. (43 - 31, 39 - 34)
Resposta: (a) + 4,85 pm; (b) - 40,52 keV; (c) + 40,52 keV; (d) 0,4 c.
CAPÍTULOS
44 - 4a ed. e 39 - 6a ed.
14. Um projétil de
Resposta: (a) 1.7x10-
J 15. Com a relação clássica entre o momento e a energia cinética, mostre que o comprimento de onda de de Broglie de um elétron pode ser escrito como:
(a) ![]() , onde K
é a energia cinética em elétron-volts, ou
, onde K
é a energia cinética em elétron-volts, ou
(b) ![]() , onde l está em nanômetros e V é o potencial
acelerador em volts. (44 - 2, 39 - 49)
, onde l está em nanômetros e V é o potencial
acelerador em volts. (44 - 2, 39 - 49)
J 16. O comprimento de onda da linha amarela do espectro de emissão de sódio é de 590 nm. Com que energia cinética um elétron teria o mesmo comprimento de onda de de Broglie? (44 - 6, 39 - 53)
Resposta: 4,32x10-6 eV.
J 17. (a) Um fóton tem energia de 1,00 eV e um elétron tem energia cinética com o mesmo valor. Quais são os respectivos comprimentos de onda? (b) Repita o problema no caso de a energia ser 1,00 GeV. (44 - 10)
Resposta: (a) 1,24 mm; 1,22 nm; (b) 1,24 fm; 1,24 fm.
J 18. O poder de resolução mais elevado de um microscópio só está limitado pelo comprimento de onda utilizado; isto é, o menor detalhe que pode ser separado tem as dimensões mais ou menos iguais ao comprimento de onda. Suponhamos que queremos "olhar" para dentro de um átomo. Admitindo que o diâmetro do átomo seja 100 pm, significa que desejamos ver detalhes da ordem de 10 pm, aproximadamente. (a) Se for usado um microscópio eletrônico, qual a energia mínima que os elétrons devem ter? (b) Se for usado um microscópio de luz, qual a energia mínima dos fótons? (c) Qual dos dois microscópios parece mais prático para este fim? Por quê? (44 - 16, 39 - 64)
Resposta: (a) 15 keV; (b) 124 keV.
J 19. Um microscópio de fótons é usado para localizar um elétron num átomo, num intervalo de distância de 10 pm. Qual é a incerteza mínima na medição do momento do elétron localizado desta forma? (44 - 41)
Resposta: 6,6x10-
Resposta: 1,33x10-
21. Imagine um jogo de bola num universo cuja
constante de Planck fosse 0,60 J.s. Qual seria a
incerteza na posição de uma bola de
Resposta: 1,2 m.
22. Suponha que queremos verificar a possibilidade de os elétrons nos átomos moverem-se em órbitas, "observando-os" com fótons de comprimento de onda suficientemente curto, por exemplo, 10 pm ou menos. (a) Qual seria a energia desses fótons? (b) Qual a energia que um desses fótons transferiria a um elétron livre num espalhamento Compton frontal? (c) O que isso lhe diz sobre a possibilidade de confirmar o movimento orbital pela "observação" de um elétron atômico em dois ou mais pontos de sua trajetória? (44 - 47, 39 - 78)
Resposta: (a) 124 keV; (b) 40,6 keV.
CAPÍTULOS
44 - 4a ed. e 40 - 6a ed.
23. (a) Calcule o menor valor permitido para a energia de um elétron confinado no interior de um núcleo atômico (diâmetro de cerca de 1,4 ´ 10-14m). (b) Compare esta energia com os vários MeV da energia de ligação dos prótons e nêutrons no interior de um núcleo. Com estas informações, é razoável esperar encontrar elétrons no interior do núcleo? (44 - 23, 40 - 3)
Resposta: (a) 1919 MeV; (b) Não.
J 24. Um elétron, confinado num poço infinito de largura 0,250 nm, está no seu estado fundamental (n = 1). Quanta energia deve absorver a fim de passar para o terceiro estado excitado (n = 4)? (44 - 25, 40 - 11)
Resposta: 90,3 eV.
25. Nos átomos há uma probabilidade finita,
embora muito pequena, de, num certo instante, um elétron orbital ser encontrado
realmente no interior de um núcleo. Na verdade, alguns núcleos instáveis
utilizam esse aparecimento ocasional do elétron para decair por um processo
denominado captura eletrônica. Admitindo que o próton seja uma esfera de
raio 1,1 ´ 10-
Resposta: 1,2x10-14.
CAPÍTULOS
43 - 4a ed. e 40 - 6a ed.
J 26. Um átomo absorve um fóton com a freqüência de 6,2´ 1014 Hz. Qual o aumento de energia do átomo? (43 - 55, 40 - 31)
Resposta: 2,56 eV.
27. (a) Verifique, pela substituição direta dos valores numéricos das constantes fundamentais, que a energia do estado fundamental do átomo de hidrogênio é - 13,6 eV.
(Veja as equações ![]() )
)
(b) Analogamente, mostre que o valor da constante de Rydberg R é 0,01097 nm-1. (43 - 58, 40 - 30)
J 28. Quais são: (a) a energia; (b) o momento linear; (c) o comprimento de onda do fóton emitido quando um átomo de hidrogênio sofre uma transição de um estado com n = 3 para o estado com n = 1? (43 - 60, 40 - 35)
Resposta: (a) 12,1 eV (b) 6,45´ 10- 27kg m/s (c) 102,6 nm.
J 29. Um átomo de hidrogênio é excitado de um estado com n = 1 até um estado com n = 4. Calcule: (a) a energia que deve ser absorvida pelo átomo; (b) as diferentes energias dos fótons que podem ser emitidos se o átomo retornar ao estado n = 1 e desenhe um diagrama destes níveis de energia. (43 - 63, 40 - 40)
Resposta: (a) 12,8 eV; (b) 12,8 eV (4 ® 1); 2,55 eV (4 ® 2); 0,66 eV (4 ® 3); 12,1 eV (3 ® 1); 1,89 eV (3 ® 2); 10,2 eV (2 ® 1).
J 30. Mostre, num diagrama de níveis de energia do hidrogênio, os números quânticos que correspondem a uma transição em que o fóton emitido tem o comprimento de onda 121,6 nm. (43 - 67, 40 - 46)
J 31. Um átomo de hidrogênio, num estado com a energia de ligação (isto é, a energia necessária para remover o elétron do átomo) de 0,85 eV, faz uma transição para um estado em que a energia de excitação (a diferença entre a energia de um estado e a do estado fundamental) é 10,2 eV. (a) Ache a energia do fóton emitido. (b) Mostre essa transição num diagrama de níveis de energia do átomo de hidrogênio, identificando os níveis com os números quânticos apropriados. (43 - 68, 40 - 47)
Resposta: (a) 2,55 eV (b) n = 4 ® n = 2.
J 32. Qual é a probabilidade de se encontrar o elétron do átomo de hidrogênio, no seu estado fundamental, entre duas esferas de raios r = 1,00 rB e r = 1,01rB? (40 - 55)
Resposta: 0,0054.
33. Para um átomo de hidrogênio no estado com n = 2 e l = 0, qual é a probabilidade de encontrar-se o elétron entre duas esferas de raios r = 5,00 rB e r = 5,01rB? (40 - 55)
Resposta: 0,0019.
J 34. No estado fundamental do átomo de hidrogênio, quais são, segundo o modelo de Bohr, as seguintes grandezas: (a) número quântico; (b) raio da órbita do elétron; (c) momento angular do elétron; (d) momento linear do elétron; (e) velocidade angular do elétron; (f) velocidade linear do elétron; (g) força sobre o elétron; (h) aceleração do elétron; (i) energia cinética do elétron; (j) energia potencial; (k) energia total.(43 - 76)
Resposta: (a) 1;
(b) 5,31 x 10-
CAPÍTULOS
45 - 4a ed. e 41 - 6a ed.
35. Calcule o módulo do momento angular orbital de um elétron num estado l = 3. (45 - 3, 41 - 4)
Resposta: 3,64x10-34 4 J.s.
J 36. (a) Qual é o número de valores possíveis de l associados a n = 3? (b) Qual é o número de valores possíveis de ml associados a n = 1? (45 - 4, 41 - 3)
Resposta: (a) 3; (b) 1.
37. Um estado do átomo de hidrogênio tem o valor máximo de ml igual a +4. O que se pode dizer sobre o restante de seus números quânticos? (45 - 8, 41 - 8)
Resposta: l = 4, n ³ 5, ms = ± ½.
J 38. Quantos estados eletrônicos com n = 5 existem no átomo de hidrogênio? (45 - 9, 41 - 10)
Resposta: 50.
J 39. O comprimento de onda da linha Ka do ferro vale 193 pm. Qual é a diferença de energia entre os dois estados do átomo de ferro (veja abaixo) que origina essa transição? Qual é a diferença de energia correspondente para o átomo de hidrogênio? Por que a diferença de energia obtida para o ferro é muito maior que a obtida para o hidrogênio? (Sugestão: no átomo de hidrogênio a camada K corresponde a n = 1, e a camada L corresponde a n = 2). (45 - 51, 41 - 44)
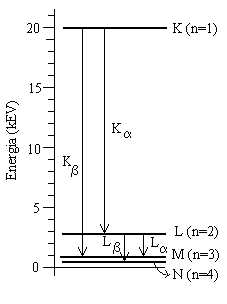 Resposta: 6,4 keV, 10,2 eV.
Resposta: 6,4 keV, 10,2 eV.
J 40. Um alvo de tungstênio (Z = 74) é bombardeado por elétrons num tubo de raios X. (a) Qual é o valor mínimo do potencial acelerador que permitirá a produção das linhas características Kb e Ka do tungstênio? (b) Para esse mesmo potencial de aceleração qual é o valor de l mín? (c) Quais são os comprimentos de onda das duas linhas Kb e Ka ? Os níveis de energia atômicos K, L e M do tungstênio são 69,5; 11,3 e 2,30 keV, respectivamente. (45 - 55, 41 - 49)
Resposta: (a) 69,5 kV; (b) 17,9 pm; (c) 21,3 pm.