© 2002 Prof. C.A. dos Santos
Texto revisado em 02/04/2002
Produção de Raios XRaios X podem ser produzidos quando elétrons são acelerados em direção a um alvo metálico (Veja o capítulo sobre A Descoberta dos Raios X para uma descrição histórica). O choque do feixe elétrons (que saem do catodo com energia da ordem de 30 Kev) com o anodo (alvo) produz dois tipos de raios X. Um deles constitui o espectro contínuo, ou bremsstrahlung em alemão, e resulta da desaceleração do elétron durante a penetração no anodo. O outro tipo é o raio X característico do material do anodo. Assim, cada espectro de raios X é a superposição de um espectro contínuo e de uma série de linhas espectrais características do anodo. O espectro contínuo é uma curva de contagens por segundo, versus comprimento de onda do
raio X. Como se viu no capítulo sobre
o efeito fotoelétrico, um fóton de radiação, com freqüência f, transporta uma energia
hf=hc/l, onde l é o comprimento de onda da
radiação.
Portanto, o raio X emitido deverá ter energia máxima igual à energia do elétron incidente. Assim,
o espectro contínuo é limitado por este valor. Na Fig. RX1
(extraída de
http://www.tulane.edu/~sanelson/geol211/x-ray.htm),
Substituindo-se o alvo de tungstênio (Z=74) por um de molibdênio (Z=42), e mantendo-se as
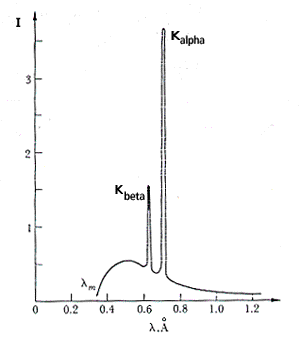
outras condições experimentais constantes, obtém-se o resultado ilustrado na Fig. RX2
(extraída de Tipler, Cap. 3).
Observe que as principais diferenças entre as figuras RX1 e RX2 são os picos existentes na Fig. RX2, em torno de 0.6 Å e 0.7 Å. Tendo em conta que a única diferença entre uma medida e outra foi a substituição do alvo, é razoável admitir que os picos são devidos ao anodo de molibdênio. Estes picos constituem o espectro de raios X característico do molibdênio. Veremos no capítulo sobre o modelo de Bohr a razão pela qual o espectro obtido com o tungstênio não apresenta os picos característicos. Os Raios X e a Tabela Periódica: A Lei de MoseleyPor volta de 1913, Henry G.J. Moseley mediu as freqüências das linhas espectrais dos raios X característicos de cerca de 40 elementos. A partir do gráfico da raiz quadrada da freqüência versus o número atômico Z do elemento, ele obteve a seguinte relação f1/2=An(Z-b), onde An e b são constantes que dependem da linha espectral. A repercussão imediata deste resultado foi a alteração da tabela periódica. Esse trabalho de Moseley teve papel importantíssimo na consolidação e aceitação internacional do modelo de Bohr. Na verdade, foi o primeiro dos trabalhos experimentais a confirmar as predições de Bohr. Antes do trabalho de Moseley o número atômico era associado à posição do átomo na tabela periódica de Mendelev, a qual distribuía os elementos de acordo com o seu peso. Moseley mostrou, por exemplo, que o argônio deveria ter Z=18, ao invés de Z=19 (conforme a tabela de Mendelev). Por outro lado, o potássio deveria ter Z=19, ao invés de Z=18. Ele também mostrou que o cobalto deve preceder ao níquel, apesar do peso atômico do Co ser maior do que o do Ni. De acordo com Mendelev, o número atômico era aproximadamente igual à metade do peso atômico. Moseley definiu o peso atômico como igual ao número de elétrons do átomo eletricamente neutro. A lei de Moseley apresentava resultados bastante diferentes daqueles do paradigma científico vigente. Através dela Moseley deduziu que entre o hidrogênio e o urânio, deveria haver exatamente 92 tipos de átomos, cujas propriedades químicas eram governadas por Z, e não pelo peso atômico. Isto significava dizer que a tabela periódica devia seguir a ordem crescente do número atômico e não a do peso atômico. Obedecida essa seqüência, os lugares correspondentes a Z = 43, 61, 75, 85 e 87 ficaram vagos. Por essa época, havia uma grande polêmica entre os químicos a respeito do número exato de terras raras; discutia-se se estas iam de Z=58 a Z=71 ou a Z=72 (veja os detalhes no texto sobre a descoberta dos Raios X). Os elementos 43 (tecnécio), 61 (promécio) e 85 (astatínio) foram obtidos artificialmente. Sendo suas vidas-médias muito curtas, esses elementos não podiam ser naturalmente produzidos, ou pelo menos observados. O elemento 75 (rénio) foi descoberto em 1925, pelo casal Noddack. O elemento 87, descoberto em 1939, por Marguerite Perey, recebeu o nome de frâncio e pertence a uma família radioativa natural. Depois de muita polêmica, ficou claro que as terras raras iam até Z=71. O elemento com Z=72 (háfnio), descoberto em 1923 por Coster e von Hevesy, é um metal de transição. Raios X e CristalografiaPor volta de 1912, Max von Laue concebeu a possibilidade de realizar difração de raios X, utilizando uma estrutura cristalina como rede de difração tridimensional. As primeiras experiências foram realizadas por dois alunos de Laue, Walter Friedrich e Paul Knipping. Logo depois Sir William Henry Bragg e seu filho Sir William Lawrence Bragg demonstraram a relação que passou a ser conhecida como lei de Bragg, fundamental para o estudo de estruturas cristalinas com o uso da difração de raios X. A Fig. RX3 ilustra o arranjo experimental. Um feixe de raios X incide sobre um conjunto
de planos cristalinos, cuja distância interplanar é d.
2dsenq =nl , onde l é o comprimento de onda da radiação utilizada, e n é um número inteiro. A expressão acima é conhecida com lei de Bragg e desempenha papel fundamental no uso da difração de raios X para estudos cristalográficos.
| Veja também |
Links interessantes sobre física Sociedade Brasileira de Física American Institute of Physics (AIP) |
Escreva-me (), críticas e comentários são bem-vindos!!! |
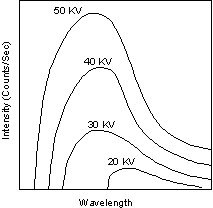 tem-se vários espectros contínuos em função
do potencial acelerador. Essas curvas foram obtidas com um alvo de tungstênio. É fácil
compreender, a partir das relações
tem-se vários espectros contínuos em função
do potencial acelerador. Essas curvas foram obtidas com um alvo de tungstênio. É fácil
compreender, a partir das relações
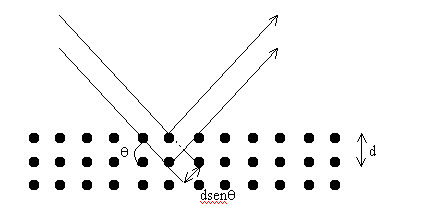 O ângulo de incidência é q. Os feixes refletidos por dois planos
subseqüentes apresentarão o fenômeno da difração. Isto é se a diferença entre seus caminhos
óticos for um número inteiro de comprimentos de onda, haverá superposição construtiva
(um feixe de raios X será observado); caso contrário, haverá superposição destrutiva, i.e. não
se observará qualquer sinal de raios X. Use estas informações e mostre, a partir da Fig. RX3,
que
O ângulo de incidência é q. Os feixes refletidos por dois planos
subseqüentes apresentarão o fenômeno da difração. Isto é se a diferença entre seus caminhos
óticos for um número inteiro de comprimentos de onda, haverá superposição construtiva
(um feixe de raios X será observado); caso contrário, haverá superposição destrutiva, i.e. não
se observará qualquer sinal de raios X. Use estas informações e mostre, a partir da Fig. RX3,
que