

Máquinas Térmicas
Para que um dado sistema realize trabalho às custas da energia retirada na forma de calor de certa fonte térmica por um processo cíclico são necessárias duas fontes térmicas com temperaturas diferentes. Os dispositivos que realizam tal atividade por processos cíclicos são chamados de máquinas térmicas . Uma máquina térmica retira certa quantidade de energia na forma de calor (Q2) da fonte quente e transfere uma parcela desta energia (Q1) para a fonte fria.
Em
um ciclo completo, o sistema retorna ao estado inicial, de modo que ΔU = 0,
já que a energia interna é função de estado.
Então, o trabalho realizado em cada ciclo fica:
W = Q2 - Q1.
O rendimento mede a eficiência com que uma máquina térmica
converte o fluxo de energia na forma de calor em fluxo de energia
na forma de trabalho. O rendimento é definido como a razão
entre o trabalho realizado no ciclo e a quantidade de energia
retirada da fonte quente na forma de calor:
r =W/Q2
ou
r = 1 - Q1/Q2
Pelo enunciado de Kelvin para a segunda lei da Termodinâmica, Q1 é sempre
diferente de zero e daí, r <1. Portanto, é
impossível construir uma máquina térmica que transforme
integralmente a energia retirada de uma fonte térmica na forma
de calor em trabalho por um processo cíclico.
Refrigeradores são dispositivos que retiram energia na forma de
calor de uma fonte fria e a transferem para uma fonte quente .
Nesta transferência, é indispensável fornecer trabalho para
realizar o ciclo. Sendo Q1 a energia retirada como calor
da fonte fria e W, o trabalho realizado sobre o sistema, a
energia transferida como calor para a fonte quente é
Q2 = W + Q1
Para um refrigerador, define-se a eficiência E pela relação:
E = Q1/W
ou
E =
Q1/(Q2 - Q1)
Pelo enunciado de Clausius para a segunda lei da
Termodinâmica, W é sempre diferente de zero. Assim, é
impossível a um refrigerador, operando em ciclos, transferir
energia na forma de calor de uma fonte fria para uma fonte quente
sem receber trabalho.
O problema, agora, é descobrir qual o máximo rendimento que se
pode obter com uma máquina térmica que funcione entre duas
fontes dadas.
A resposta está no teorema de Carnot
Para demonstrar o teorema, consideremos duas máquinas
reversíveis A e B, com rendimentos r e r',
respectivamente.
Suponhamos que r>r'.Então W’ > W
e Q1’ <Q1. Como as máquinas são reversíveis,
podemos acoplar uma a outra mas com a máquina A operando
como refrigerador. O resultado efetivo, então, é o seguinte:
a fonte quente fica inalterada, a fonte fria perde a quantidade (Q1
- Q1’) de energia na forma de calor e é produzido um
trabalho (W’ - W).
Portanto, existe como único efeito a produção de trabalho às
custas da energia retirada na forma de calor de uma única fonte
térmica. Como isto viola a segunda lei da Termodinâmica a
condição r <r' é falsa.
Suponhamos, agora, que r > r'.
O
mesmo argumento pode ser repetido, apenas trocando entre si os
papéis desempenhados pelas duas máquinas. Assim, a máquina B
opera agora como refrigerador. E chegamos a conclusão de que a
condição que r > r' é falsa.
Como
r não pode ser maior nem menor do que r', então r
= r'. Isto demonstra o teorema de Carnot.
Uma conseqüência imediata deste teorema é o seguinte: uma
máquina térmica irreversível sempre tem um rendimento menor do
que uma máquina reversível que opere entre as mesmas
temperaturas.
Para demonstrar este fato, suponhamos que a máquina B seja irreversível. Na primeira parte da demonstração do teorema de Carnot mostramos que a condição r < r' é falsa. Mas, agora, a condição r < r' não é falsa. Como temos W’ Q1, ao acoplar as duas máquinas como antes, o resultado efetivo é o seguinte:
A fonte quente permanece inalterada, a fonte fria recebe a quantidade (Q1' - Q1) de energia na forma de calor e existe o consumo de uma quantidade (W - W’) de energia na forma de trabalho.
Ou seja, existe a transformação, perfeitamente possível, de um
fluxo de energia na forma de trabalho em um fluxo de energia na
forma de calor.
Assim, para que se obtenha o máximo rendimento, os processos
envolvidos devem ser reversíveis.
Um argumento interessante para mostrar que o trabalho é máximo
(e daí, também o rendimento) quando o processo em questão é
reversível é o seguinte:
Consideremos um gás dentro de um cilindro fechado por um pistão móvel e sem atrito, sobre o qual repousa um corpo A, de massa m. O gás está isolado termicamente e em equilíbrio.
Para descobrir que processo (adiabático) permite ao gás realizar o máximo de trabalho contra a vizinhança, como primeira tentativa, deslocamos o corpo A horizontalmente .
Com isso, o pistão dispara para cima e (depois de algumas
oscilações) atinge um estado de equilíbrio a uma certa altura h.
Como o corpo A não foi deslocado verticalmente, o
trabalho realizado pelo gás sobre o corpo é nulo.
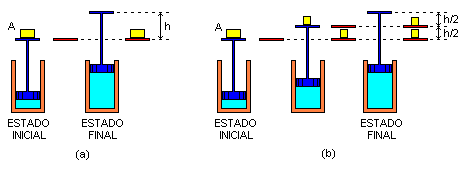
Como segunda tentativa (e partindo do mesmo estado inicial)
deslocamos metade do corpo A horizontalmente .
Com isso, o pistão dispara para cima e alcança o equilíbrio a
uma altura h/2. Então, deslocamos horizontalmente a outra
metade do corpo A e, com isso, o pistão alcança a
posição de equilíbrio final elevando-se mais h/2.
Nesta segunda tentativa, o gás realizou trabalho sobre a metade do corpo A, elevando-a a uma altura h/2. Então:
W = (m/2)g(h/2) = (1/4)mgh
Como terceira tentativa, dividimos o corpo A em três
partes iguais, repetindo o procedimento feito na segunda
tentativa, deslocando-se horizontalmente uma parte de cada vez.
Assim, o trabalho realizado pelo gás fica:
W = (2m/3)g(h/3) + (m/3)g(h/3) = (1/3)mgh
A partir dos resultados destas tentativas podemos perceber que o
trabalho realizado pelo gás é máximo quando o corpo A
for dividido no maior número possível de partes e estas forem,
uma a uma, deslocadas horizontalmente.
Cada vez que movemos horizontalmente uma dessas partes, o gás
sofre uma pequena mudança com o pistão subindo uma pequena
fração da altura h.
A última parte do corpo original será deslocada horizontalmente com o pistão quase na altura h. No final das contas, o trabalho realizado pelo gás é equivalente ao trabalho de elevar o corpo A até uma altura h/2. E então:
W = WMAX = (1/2)mgh
O processo levado em passos infinitesimais (e sem atrito) é o
que permite ao gás realizar o trabalho máximo. O processo
levado em passos infinitesimais é quase-estático e porque não
existe atrito, é reversível.
Se tivéssemos considerado um processo adiabático de
compressão, o processo levado a cabo reversivelmente é o que
custaria da vizinhança o trabalho mínimo sobre o sistema.
Como a condução de energia na forma de calor é irreversível,
as trocas de energia na forma de calor com as fontes quente e
fria devem ser isotérmicas (cada troca à temperatura da
respectiva fonte).
Pela mesma razão, os processos onde há variações de
temperatura devem ser adiabáticos, sem troca de energia na forma
de calor. Em outras palavras, uma máquina reversível que
funcione entre duas temperaturas deve operar necessariamente
segundo um ciclo de Carnot.
Para o ciclo de Carnot, Q1/Q2 = T1/T2.
Então, o rendimento de uma máquina de Carnot pode ser expresso
em função das temperaturas absolutas das duas fontes:
r
= 1 - T1/T2
Independentemente da substância de operação na máquina.
Assim, fica evidente que todas as máquinas térmicas de Carnot que trabalham entre as mesmas temperaturas T1 e T2 têm o mesmo rendimento.
Uma máquina real sempre terá um rendimento menor do que o rendimento das máquinas de Carnot que trabalham entre as mesmas duas temperaturas.
Do mesmo modo, a eficiência de um refrigerador de Carnot pode ser expressa em função das temperaturas absolutas das duas fontes:
E = T1/(T1 - T2)