Baixe o manual resumido do laboratório aqui
1 - OBJETIVO
Determinação da constante g
para o ar através de uma expansão adiabática,
utilizando o "método de Clement & Désormes".
2 - INTRODUÇÃO
Transformações adiabáticas (TA) são extremamente importantes em diversas aplicações tecnológicas (motores à combustão, refrigeradores, condicionadores de ar, ...). Quando um gás se expande adiabaticamente - isto é, sem trocar calor com as vizinhanças - ele realiza trabalho sobre as vizinhanças, diminuindo sua energia interna e a sua temperatura. Quando é comprimido adiabaticamente, as vizinhanças realizam trabalho sobre o gás, aumentando sua energia interna e sua temperatura. Uma TA pode ser realizada em uma câmara isolada termicamente ou realizando uma mudança rápida no volume do gás.
Durante a TA a pressão p e o volume V se relacionam de acordo com:
pVg constante;
onde ![]() . CP
e CV são os respectivos calores específicos
molares a pressão e a volume constantes.
. CP
e CV são os respectivos calores específicos
molares a pressão e a volume constantes.
Neste experimento determinaremos o valor de g para o ar, com auxílio de um recipiente metálico. A pressão no interior do recipiente será medida com auxílio de um manômetro de água. Uma bomba permitirá introduzir mais ar no recipiente e uma válvula permitirá igualar a pressão no interior do recipiente com a pressão atmosférica. A introdução rápida de ar no recipiente, com auxílio da bomba, comprime adiabaticamente o ar que já se encontra no interior do recipiente; a saída rápida de ar do recipiente, quando a válvula é aberta, permite que o ar no interior do recipiente se expanda adiabaticamente.
3 - PROCEDIMENTO EXPERIMENTAL


Iniciaremos o experimento igualando a pressão no interior do recipiente com a pressão atmosférica ( po ). A temperatura no interior do recipiente será igual à temperatura ambiente ( To ) pois as paredes do recipiente são de metal, ótimo condutor de calor; se porventura a temperatura fosse diferente, bastaria esperar algum tempo para que o equilíbrio térmico ocorresse. Experimentalmente sabemos que a pressão no interior é igual à pressão atmosférica se a superfície livre das colunas de água no manômetro estiverem niveladas (vide a Figura 1). O ar contido inicialmente no recipiente estará ocupando o volume Vo.
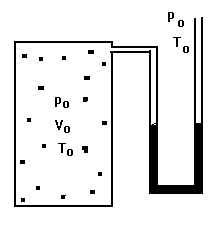
FIGURA 1.
Em seguida introduziremos ar com auxílio da bomba (não representada nas figuras) e o sistema atingirá um estado em que a temperatura (T1) e a pressão (p?1) serão superiores às externas. O ar, inicialmente contido no recipiente, ocupará agora um volume menor (V1). O sistema se apresentará como na Figura 2.
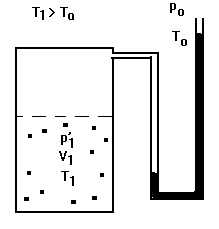
FIGURA 2.
Aguardaremos algum tempo para que a temperatura no interior do recipiente volte a ser igual à temperatura externa (To ). Durante este processo a pressão no interior do recipiente diminuirá, atingindo finalmente uma pressão p1 maior do que a pressão atmosférica mas menor do que p?1; o volume permanecerá constante (V1). Observaremos, nesse processo, o desnível entre as colunas de água no manômetro dimunindo, finalmente estabilizando-se de acordo com a figura 3.
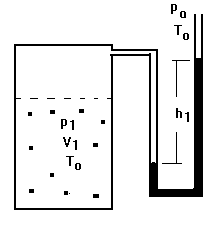
FIGURA 3.
Realizaremos então a medida da pressão p1; para tanto mediremos o desnível h1 em milímetros. A pressão será:
p1 = po + h1; onde po é a pressão atmosférica em mm de H2O.
Em seguida, abriremos a válvula na parte superior do recipiente (não representada nas figuras) por um pequeno intervalo de tempo, fechando-a tão logo o manômetro mostre que a pressão no interior é igual à atmosférica. Esta expansão, por ser rápida, é adiabática. O ar no recipiente aumentará de volume, sendo V2 o volume daquela parte que inicialmente era Vo (ar no recipiente no início); a temperatura T2 será então menor do que a externa. O sistema se apresentará de acordo com a Figura 4.
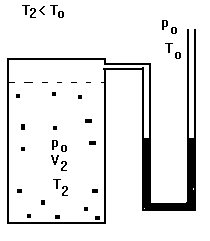
FIGURA 4.
Sendo a temperatura menor no interior, entrará calor no recipiente. Quando a temperatura for novamente igual à externa, como o volume V2 não mais variou (a válvula estava fechada durante a entrada de calor no recipiente), a pressão será mais elevada que a atmosférica; esta pressão p2 mediremos (p2= po+ h2). O sistema se apresentará de acordo com a Figura 5.
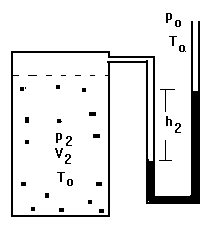
FIGURA 5.
O ar no recipiente nos estados representados pelas Figuras 1, 3 e 5 estará sempre à mesma temperatura To; em um diagrama p versus V, os pontos que representam os três estados do gás, inicialmente no interior do recipiente, estão sobre a mesma isotérmica. Desta forma valem as seguintes relações:
![]() (1)
(1)
A transformação que conecta os estados representados pelas figuras 3 e 4 é adiabática. Portanto vale:
![]() (2)
(2)
De (2) obtém-se:
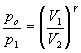 (3)
(3)
De (1) obtém-se:
![]() (4)
(4)
Substituindo-se (4) em (3) obtém-se:
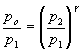 (5)
(5)
Tomando-se o logaritmo de (5) e isolando-se g, chega-se finalmente a:
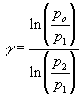 (6)
(6)
Desta forma, de (6) constatamos que, medindo-se três pressões, podemos calcular o valor de g. Você deverá medir as pressões p1 ep2 realizando a sequência de operações propostas anteriormente; repita três vezes essas medidas. A pressão atmosférica po será obtida com um barômetro em mm de Hg; converta-a para mm de H2O multiplicando a anterior por 13,6 (o mercúrio é 13,6 vezes mais denso que a água). Calcule o valor de g nas três situações e obtenha o valor médio.