Osmose
Nem sempre uma membrana é permeável a todas as partículas. O que ocorre, então, quando há desequilíbrio de partículas entre dois compartimentos e a membrana é impermeável a essas partículas? O ocorre a difusão do solvente (água), e essa difusão chama-se osmose.
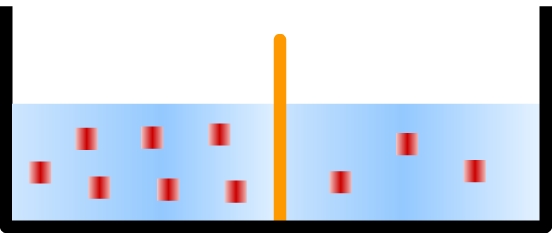
Observe a figura abaixo:
Figura 3. Modelo
Supondo que o traço laranja é uma membrana semipermeável (permeável à água, mas não aos quadrados vermelhos), como o sistema vai entrar em equilíbrio?
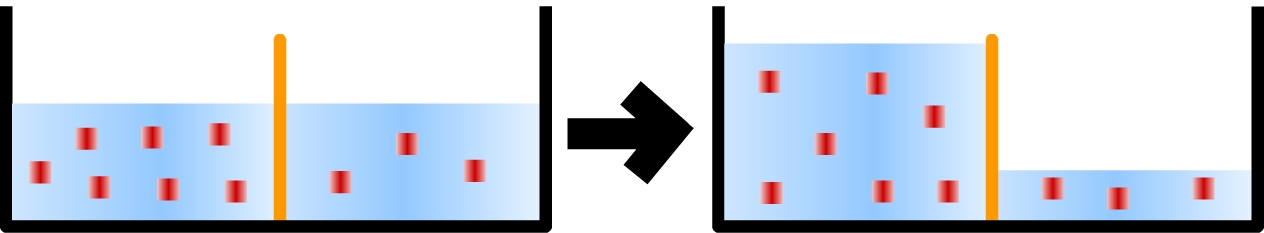
Figura 3. Modelo de osmose
A água do compartimento menos concentrado passa para o mais concentrado, por osmose, através da membrana semipermeável, para que o sistema atinja o equilíbrio. Importante: a água está em constante trânsito através da membrana, independente da concentração; na osmose, ocorre um desbalanço líquido da quantidade de água.
Nos organismos vivos, as membranas são seletivamente permeáveis a solutos e permeáveis à água, portanto a osmose é um processo muito comum. Exemplo: quando se injeta uma solução menos concentrada que o plasma humano (ou seja, uma solução pobre em solutos), o plasma sofre uma diluição; essa diluição faz com que o excesso de água penetre as células sanguíneas, por osmose, as quais aumentam de volume e podem até sofrer lise.
Como sabemos se uma solução possui a mesma concentração dos fluidos biológicos? A medida da concentração de partículas de uma solução é a osmolaridade. Uma solução 1 osmol/L (1 osmolar) contém um mol de partículas em um litro de solução, independentemente do caráter da partícula: glicose, frutose, sódio, cloreto, cálcio, uma mistura de todos esses ou outros. Exemplo: uma solução 1 molar de glicose é 1 osmolar; uma solução 1 molar de NaCl é 2 osmolar, pois NaCl dissocia-se, e temos 1 molar de Na+ e 1 molar de Cl-, ou 2 molar de partículas = 2 osmolar. A osmolaridade dos líquidos biológicos é 0,3 osmolar, independentemente dos solutos presentes; portanto, uma solução isotônica a qualquer fluido biológico possui 0,3 osmolar, uma hipotônica possui menos de 0,3 osmolar e uma hipertônica possui mais de 0,3 osmolar. Para não ocorrer lise nem crenação (perda excessiva de água, tornando a célula “murcha”) das hemácias, é importante que toda solução que for administrada intravenosamente seja isotônica ao plasma.